* Ley de Raoult
La ley fue enunciada en 1882 por el químico francés Francois Marie Raoult (1830-1901).
Esta ley establece que la relación entre la presión de vapor de cada componente en una solución ideal es dependiente de la presión de vapor de cada componente individual y de la fracción molar de cada componente en la solución.
Y señala que:
"Si un soluto tiene una presión de vapor medible, la presión de vapor de su disolución siempre es menor que la del disolvente puro."
Definiéndolo de esa manera la relación entre la presión de vapor de la solución y la presión de vapor del disolvente depende de la concentración del soluto en la disolución.
Entonces tendríamos:
Es decir que la presión de vapor del soluto crece linealmente con su fracción molar. En una solución que sólo contenga un soluto, se tiene que X1= 1 – X2, donde X2 es la fracción molar del soluto, pudiendo escribir la formulación de la ley como:
Se puede ver de esta forma que una disminución en la presión de vapor, 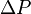 es directamente proporcional a la concentración del soluto presente.
es directamente proporcional a la concentración del soluto presente.
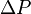 es directamente proporcional a la concentración del soluto presente.
es directamente proporcional a la concentración del soluto presente.
Una vez que los componentes de la solución han alcanzado el equilibrio químico, la presión total del vapor es:
y la presión individual de los componentes gaseosos es
donde
- (Pi)puro es la presión de vapor del componente puro
- Xi es la fracción molar del componente en solución
Consecuentemente, a medida que el número de componentes gaseosos de la solución crece, la fracción molar y la presión en la solución de cada uno de ellos va decreciendo. Si se tuviera un soluto puro, tendiendo a infinito número de solutos, se alcanzaría el valor nulo de presión de vapor (es decir el cuerpo no se evaporaría). En este caso la presión de vapor de la disolución sería igual a la suma de las presiones parciales de cada componente (Ley de las presiones parciales o ley de Dalton).
Aplicación
Se cumple sólo para disoluciones ideales no obstante es una buena aproximación cualitativa.
Para que se cumpla al 100% la ley de Raoult es necesario que el líquido sea una disolución ideal, el vapor sea una mezcla de gases ideales y que la fugacidad del líquido no varie significativamente con la presión, esta última condición a veces se expresa como que el factor de corrección de poynting sea de valor 1.
En equilibrio líquido-vapor, la relación que se comporta según la idealidad de la ley de Raoult seria la siguiente:
donde:
 = presión total del sistema en equilibrio
= presión total del sistema en equilibrio = composición en la fase vapor, compuesto 1
= composición en la fase vapor, compuesto 1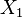 = composición en la fase líquida, compuesto 1
= composición en la fase líquida, compuesto 1 = presión de vapor, compuesto 1
= presión de vapor, compuesto 1
Esta ley se define con lo siguiente:
"A temperatura constante y a saturación, la cantidad de gas disuelta en un líquido es proporcional a la presión ejercida por el gas en contacto con el líquido."
Una forma de comprender bien esta Ley es "el ejemplo de la botella de gaseosa":
*La botella sin destapar tiene burbujas en su interior, parece agua pero sabemos que lleva CO 2 en su interior, sin embargo no se ve, esto es debido a que el gas por efecto de la presión a la que ha sido sometido durante el llenado se ha diluido en el líquido hasta alcanzar el estado de equilibrio. Al destapar la botella, la presión disminuye por efecto de la Ley de Henry y la cantidad de gas disuelto también disminuye, el gas sobrante es liberado en forma de burbujas.
De manera matemática, 
(La cual es una forma de plantear la ley de Henry, pero no la más útil).
Cuando una persona entra en la CHIPER, su organismo se encuentra en un estado de saturación en el ambiente atmosférico, que es el habitual. Una vez iniciada la presurización, se crea un desequilibrio, lo cual obliga al líquido y a los tejidos a aumentar la tasa de gas en busca de un nuevo estado de equilibrio (saturación).
Una vez el gas está disuelto en el líquido, experimentará una presión (P) hacia el gas sin disolver, que se conoce con el nombre de tensión (T), dependiendo de los valores de la presión y de la tensión habrá lugar a tres estados de disolución:
*Si P > T Estado de Subsaturación
En el estado de subsaturación, el líquido absorbe más gas, debido a que la presión del gas es mayor que la tensión del gas en el líquido, que en el paciente es el momento del comienzo de la presurización.
*Si P = T Estado de equilibrio o Saturación
En el estado de saturación, el líquido ya no puede absorber más gas a esa presión, debido a que la presión del gas es igual a la tensión de dicho gas en el seno del líquido; es la base del buceo a saturación.
*Si P < T Estado de Sobresaturación
En el estado de sobresaturación, el líquido elimina gas porque la presión del gas es menor que la tensión del gas en el seno del líquido, que en el buceador y en el paciente se da en el momento del ascenso.
*DETERMINACIÓN DE PPM EN FASES LÍQUIDAS*
ppm significa partes por millón, es decir, los mg (miligramos) que hay en un kg de disolución; como la densidad del agua es 1, 1 kg de solución tiene un volumen de aproximadamente 1 litro, los ppm son también los mg de una sustancia en un litro
Expresado de otra forma: mg/l
(Siguiendo el mismo razonamiento, los ppm también son los gramos que contiene cada metro cúbico, g/m3)
Para calcular los ppm se divide el peso en mg por el volumen el litros.
Expresado de otra forma: mg/l
(Siguiendo el mismo razonamiento, los ppm también son los gramos que contiene cada metro cúbico, g/m3)
Para calcular los ppm se divide el peso en mg por el volumen el litros.
Por ejemplo, una disolución de 15 gramos (g) en 3 metros cúbicos de agua:
15 g x 1000 mg/g = 15000 mg
3 m3 x 1000 l/m3 = 3000 l
Concentración: 15000 / 3000 = 5 mg/l = 5 ppm
15 g x 1000 mg/g = 15000 mg
3 m3 x 1000 l/m3 = 3000 l
Concentración: 15000 / 3000 = 5 mg/l = 5 ppm
*DETERMINACIÓN DE PPM EN FASES SÓLIDA*
Partes por millón (abreviado como ppm) es la unidad empleada usualmente para valorar la presencia de
elementos en pequeñas cantidades (traza) en una mezcla. Generalmente suele referirse a porcentajes
en peso en el caso de sólidos y en volumen en el caso de gases (caso del ppm utilizado en calidad
del aire).
Así, 5 ppm de CO equivale a decir que existen 5 unidades de volumen de CO por cada millón de
unidades de volumen de aire. Por ejemplo, 5 ppm de CO serían 5 litros de CO en cada millón de litros
de aire.
De forma análoga, para transformar N ppm de un gas a mg/m3
en determinadas condiciones de Presión
y Temperatura, se realiza con:
Nppm x M/V(atm.T) = mg/m3
* Presiones Parciales
En 1801 John Dalton postulo “ los componentes de una mezcla gaseosa parecieran ejercer presión sobre las paredes del recipiente en el cual estaban confinados de manera independiente unos de otros”.
La ley de las presiones parciales de DALTON establece que la presión total que un gas ejerce una mezcla de gases es igual a la suma de las presiones parciales de los gases individuales.
La ley de las presiones parciales de Dalton se cumple en la mayoría de las mezclas gaseosas siempre y cuando los gases no reaccionen
PT = P1 + P3 + P3 + ……… + P n
La presión parcial de un gas ideal en una mezcla es igual a la presión que ejercería en caso de ocupar él solo el mismo volumen a la misma temperatura. Esto sucede porque las moléculas de un gas ideal están tan alejadas unas de otras que no interactúan entre ellas. La mayoría de los gases reales se acerca bastante a este modelo.
Como consecuencia de esto, la presión total, es decir la suma de todas estas presiones, de una mezcla en equilibrio es igual a la suma de las presiones parciales de los gases presentes. Por ejemplo, para la reacción dada:
- N2 + 3H2 ↔ 2NH3
La presión total es igual a la suma de las presiones parciales individuales de los gases que forman la mezcla:
Donde P es la presión total de la mezcla y Px denota la presión parcial de x.
Para calcular la presión parcial de un gas basta con multiplicar su fracción molar por la presión total de la mezcla. Es decir:
Si se disminuye el volumen del recipiente, la presión total de los gases aumenta. Por ser la reacción reversible, la posición de equilibrio se mueve hacia el lado de la reacción con un menor número de moles (en este caso, el producto del lado derecho). Por el Principio de Le Châtelier, esto sería como aumentar la fracción de la presión completa disponible a los productos, y disminuir la fracción disponible a los reactivos (porque hay más moles de reactivo que de producto). Varía la composición de los gases, por lo que aumenta la presencia de amoníaco. De forma similar, un cambio en la temperatura del sistema propicia la producción de reactivos (porque la reacción inversa es endotérmica).
La presión parcial de un gas es proporcional a su fracción molar, lo que es una medida de concentración. Esto quiere decir que se puede hallar la constante de equilibrio para una reacción en equilibrio que involucre una mezcla de gases a partir de la presión parcial de cada uno y la fórmula química de la reacción. La constante de equilibrio para los gases se denota como KP. Para una reacción:
- aA + bB ↔ cC + dD
Así, la constante de equilibrio KP se puede calcular con,
Aunque la composición de los gases varía cuando se comprime el recipiente, el equilibrio permanece invariante (asumiendo que la temperatura permanezca también constante).
Fase líquida frente a fase gaseosa
La presión parcial en un fluido es igual a la del gas con el que el fluido está en equilibrio.
Cuando se expone un líquido a un gas, las moléculas del gas se disolverán en el líquido.












Es claro cuando explica que la presión de vapor es directamente proporcional a la concentración del soluto presente, por lo tanto obedece a la ley de Raoult, recordando que la presión de vapor es la que libera un liquido inmediatamente después de ser retirado de cierta temperatura y sucede de manera natural. Es importante que la soluciones tengas sus propiedades coligativas para que así obedezcan claramente a la ley anteriormente mencionada con sus concentraciones bien definidas.
ResponderBorrarTendremos fracciones molares que tendrán función dentro de la misma ecuación y estas serán del aire y el vapor. Como dos principales variables a manejar.
La ley de Henry explica claramente que a una temperatura fija la cantidad de un gas disuelto en una cantidad dada de solvente es proporcional a la presión parcial del gas sobre la solución. Entonces como primero necesitamos conocer sobre presiones parciales debemos contar con datos detallados de un ejemplo por así decirlo donde conozcamos tanto al temperatura que se maneja como la sustancia que se maneja para así conocer su volumen. La fraccion molar la empleamos para limitar la `propiedad a trabajar.
en la esta publicación nos da a conocer las leyes de raoult que especifica la relación que tiene la presión de vapor que posee cada componente para ello hace mención acerca las fracciones molares que se tienen en el componente, y que no debe de rebasar el 100% igual a 1.
ResponderBorrarpara ley de henry da a conocer que cuando la presión parcial del gas aumenta la concentración de gas disuelto también aumenta. Si P mayor T Estado de Subsaturación
En el estado de saturación el líquido absorbe más gas, debido a que la presión del gas.cuando P es igual T Estado de equilibrio o Saturación
En el estado de saturación el líquido ya no puede absorber más gas a esa presión debido a que la presión del gas e
cuando P menor que T Estado de Sobresaturación
En el estado de sobresaturación, el líquido elimina gas porque la presión del gas es menor que la tensión del gas
tambien involucra lo las partes por millón del componente.
En la presente publicación nos da a conocer que es la presión de vapor y cuales son la leyes por las que se rigen, como primer punto esta la ley de Raoult que nos señala que la relación entre la presión de vapor de cada componente en una solución ideal es dependiente de la presión de vapor de cada componente individual y de la fracción molar de cada componente en la solución.
ResponderBorrarla siguiente ley es la de henry que nos dice que a temperatura constante y a saturación, la cantidad de gas disuelta en un líquido es proporcional a la presión ejercida por el gas en contacto con el líquido, en esta nos menciona un claro ejemplo, que al destapar una botella la presión disminuye por efecto de la Ley de Henry y la cantidad de gas disuelto también disminuye, el gas sobrante es liberado en forma de burbujas. también nos hace énfasis la ley de las presiones parciales.
La ley de las presiones parciales de Dalton establece que la presión total que un gas ejerce una mezcla de gases es igual a la suma de las presiones parciales de los gases individuales.
Como ya se menciono en el articulo anterior la ley de Raoult establece que la presiòn de vapor del solvente en una soluciòn es directamente proporcional a la fracciòn molar del solvente presente en la soluciòn.
ResponderBorrarla ley de Henry establece que la "masa de gas disuelto en un determinado volumen de solvente es directamente proporcional a la presiòn parcial del gas que esta en equilibrio con la soluciòn". En principio, la ley de Henry se aplica a cualquier soluto, asì que mientras que la ley de Raoult concibe el solvente ideal como aquel cuya presiòn de vapor es directamente proporcional a su fracciòn molar, de forma similar la ley de Henry ve el soluto ideal como aquel cuya presiòn de vapor es directamente proporcional a su fracciòn molar. Por tanto, en cierto sentido, la ley de Raoult puede considerarse como una aplicaciòn "especial" de la ley de Henry en la cual la constante de proporcionalidad tiene un valor particular (pº) igual a la presiòn de vapor del componente puro a la misma presiòn y temperatura.
Y la ley de las presiones parciales establecidas por Dalton dice que la presión total que un gas ejerce una mezcla de gases es igual a la suma de las presiones parciales de los gases individuales.
Y nos menciona que la presión parcial de un gas es proporcional a su fracción molar, lo que es una medida de concentración. Esto quiere decir que se puede hallar la constante de equilibrio para una reacción en equilibrio que involucre una mezcla de gases.
Este comentario ha sido eliminado por el autor.
ResponderBorrarTanto la ley de Raoult como la ley de Henry, nos dicen que la presión de vapor de un componente es proporcional a su fracción molar en la solución. . En la ley de Raoult, la constante de proporcionalidad es la presión de vapor del componente puro, P* , que depende de T y de la presión sobre el líquido. En la ley de Henry la constante de proporcionalidad es la constante de Henry, K, que depende de T, de la presión sobre el líquido y del solvente.
ResponderBorrarCuando se tiene una presión parcial en un fluido se iguala a la del gas con el que el fluido está en equilibrio.
Cuando se expone un líquido a un gas, las moléculas del gas se disolverán en el líquido.
Las partes por millón (abreviado como ppm) es la unidad empleada usualmente para valorar la presencia de elementos en pequeñas cantidades (traza) en una mezcla. Generalmente suele referirse a porcentajes en peso en el caso de sólidos y en volumen en el caso de gases (caso del ppm utilizado en calidad del aire).
Como tal tenemos que conocer las presiones parciales y debemos contar con datos detallados de un ejemplo por así decirlo donde conozcamos tanto al temperatura que se maneja como la sustancia que se maneja para así conocer su volumen.
Para el tratamiento de productos prácticamente puros se basa en el principio de la Ley de Raoult aplicandolo al componente mayor y la ley de Henrry al componente menor en cada extremo de la curva de equilibrio de un sistema vapor-liquido.
ResponderBorrarPor otro lado la ley de Raoult es una buena aproximación para mezclas de compuestos similares, como la parafina que se encuentran en fracciones de petróleo de baja temperatura de ebullición o de aromáticos recuperados a partir de la producción de coque. Sin embrago, a presiones de vapor, variando proporcionalmente con la presión total debido a los efectos de compresibilidad.
Estas leyes implican un factor k donde depende fuertemente de la temperatura debido a la variación de la presión de vapor, pero los valores relativos de k para dos componentes solo varían moderadamente con la temperatura, involucrando la pA presiones parciales del componente A en el vapor de Pa, PA es la presión de vapor de A puro en PA, y XA es la fracción mol de A en el liquido . Esta ley solo es valida para soluciones ideales, como benceno-tolueno, hexano-heptano, y alcohol metílico-alcohol etílico, que por lo general son sustancias muy similares entre si. Muchos sistemas que son sustancias ideales o no ideales siguen la ley de Henry en soluciones diluidas. Como se muestra en la siguiente formula:
p_A= P_A*X_a----FORMULA 1
CITLALI ESMERALDA MONDRAGON RAMIREZ
En este blog se describe la ley de Raoult la cual nos dice que Si un soluto tiene una presión de vapor medible, la presión de vapor de su disolución siempre es menor que la del disolvente puro asi como cabe mencionar que la ley de Raoult suele ser aplicada a componentes mayores mientras que otra ley y muy importante es la ley de Henrry la cual es para un componente menor en un sistema de vapor liquido.
ResponderBorrarasi como cabe mencionar que dichas leyes solo suelen ser validas para soluciones ideales.
dentro de la ley de Henryy nos describe que cuando
P > T se encuentra en un Estado de Subsaturación
donde el líquido absorbe más gas.
caundo P = T esta en un Estado de equilibrio o Saturación
asi que el líquido ya no puede absorber más gas a esa presión, debido a que la presión del gas es igual a la tensión
P < T Estado de Sobresaturación
donde el líquido elimina gas porque la presión del gas es menor que la tensión del gas.
Despues de terminar de leer leyes de Raoult y Henrry viene la ley de las presionses parciales la cual nos enuncia que
* la presión total que un gas ejerce una mezcla de gases es igual a la suma de las presiones parciales de los gases individuales.
estos enunciados son de gran ayuda ya que por medio de estas se puede calcular presiones de vapor a sutancias y soluciones que se encuentran en diferentes estados.
*LESLY MESA BAUTISTA
IQ-502
ley de Raoult
ResponderBorrarCuando hablamos de concentraciones y fracciones molares, involucramos a la ley de Raoult, las variables que se utilizan son; presion de vapor y fraccion molar esta ley establece una relacion entre un soluto con la presión de vapor medible, depende de la disolucion de la presión de vapor por tanto sera menor que la del disolvente, si relacionamos la presion del vapor que se genera por la solucion las presiones del disolvente muchas de las veces dependera de la concentracion.
Para que se cumpla la ley de Raoult el liquido de la solucion tiene que ser ideal que qeuiere decir esto que; a medida que se añade materia mas volatil, diminuye la presion en la fase vapor, al utilizar los gases se necesita tener un liquido que no tenga variacion en la presion por tanto tendremos que la presion se necesita que ser constante,si una solucion tiene propiedades especificas las concentraciones cumpliran facilmente esta ley.
ley de henry
para que se cumpla la ley de henry necesitamos tener en cuenta variables como lo son la temperatura, presion y concentracion esta ley nos menciona que si tenemos una temperatura constante + una saturacion = la cantidad de gas disuelta en un liquido un ejemplo acerca de esta ley es las precauciones que deben tomarse al volver a un buzo a la superficie. Al disminuir la presión parcial de los distintos gases, disminuye la solubilidad de los mismos en la sangre, con el consiguiente riesgo de una eventual formación de burbujas.
Tenemos a la presion y temperatura que estan en contacto con esta la ley y nos establece que:
P>T= Estado de subsaturacion
P=T Estado de equilibrio o saturacion
P<T Estado de sobresaturacion
Para que se lleven a cabo estas dos leyes se involucran a la concentracion dependeiendo si esta en fase liquida o solida se necesita hacer un analisis para saber que variables se involucraran.
la ley de Raoult nos menciona que "Si un soluto tiene una presión de vapor medible, la presión de vapor de su disolución siempre es menor que la del disolvente puro.", mientras que la ley de Henrynos dice que "A temperatura constante y a saturación, la cantidad de gas disuelta en un líquido es proporcional a la presión ejercida por el gas en contacto con el líquido."
ResponderBorrarEstas 2 leyes tienen un factor en comun el cual depende de la temperatura debido a la variación de la presión de vapor, mencionando tambian que Si se disminuye el volumen del recipiente, la presión total de los gases aumenta. Por ser la reacción reversible.
La ley de Raoult y Henry emplean de manera adecuada la forma de como obtener la presión de vapor mediante concentraciones y fracciones parciales que dentro de estas incluye algunas ecuaciones de Daltón como se explica en el presente blogspot por medio de estas. Una solución para la presión de vapor también se puede obtener la presión de vapor en fases solidas o liquidas determinando las partes por millón y como bien describe de la ley de Raoult "Si un soluto tiene una presión de vapor medible, la presión de vapor de su disolución siempre es menor que la del disolvente puro." esto sucede porque el disolvente que se agrega depende mucho de su concentración.
ResponderBorrarY en la ley de Henry describe que "A temperatura constante y a saturación constante, la cantidad de gas disuelta en un líquido es proporcional a la presión ejercida por el gas en contacto con el líquido." esto sucede porque como el ejemplo lo dice en una botella explica que empieza a burbujear y esto sucede porque no tiene una salida si la botella esta tapada tiende a explotar por la presión que se esta ejerciendo entre el liquido y el gas y seria muy distinta esta presión cuando este liquido sale porque la presión cambia.
Para la presión parcial de un gas ideal en una mezcla es que esta es igual a la presión que ejercería en caso de ocupar él solo el mismo volumen a la misma temperatura. Esto sucede porque las moléculas de un gas ideal están tan alejadas unas de otras que no interactúan entre ellas; es por ello que la presión total, es decir la suma de todas estas presiones, de una mezcla en equilibrio es igual a la suma de las presiones parciales de los gases presentes.
La información del artículo anterior nos menciona aspectos relevantes con respecto a la presión de vapor y/o solutos y solventes; como lo es la ley de Raoult antes mencionada “si un soluto tiene una presión de vapor medible, la presión de vapor de su disolución siempre es menor que la del disolvente puro” por lo que la presión del soluto será proporcionalmente a la fracción molar que esté presente en la solución dependiendo de la concentración que se tenga.
ResponderBorrarLa ley de Henry establece que "masa de gas disuelto en un determinado volumen de solvente es directamente proporcional a la presión parcial del gas que está en equilibrio con la solución" en este caso se tomara en cuenta variables como lo son la temperatura, presión y concentración ya que esta definen en un sistema o fase en la que se encuentre.
La ley de las presiones parciales de Dalton establece que la presión total que un gas ejerce una mezcla de gases es igual a la suma de las presiones parciales de los gases individuales.
Dentro de la cuales podemos recabar que la leyes de presión antes mencionadas hablan de presiones de vapor en distintos aspectos y propiedades de las cuales se estén trabajando, por lo que estas implican una variación de vapor para valores relativos, teniendo en consideración un punto de equilibrio sin embargo estas pueden varias respecto a los efectos de compresibilidad; los componentes dependen de la variación de temperatura, presiones parciales del componente entre otras por lo que la presión parcial de un fluido será igual a la del gas con el que el fluido en otro cas si se expone un líquido a gas estas va a tender a formar parte del líquido por lo que se disolverán para formar una mezcla.
.
VIVIANA CELESTINO SEGUNDO
Son muchas las propiedades de las disoluciones, entre ellas densidad, índice de refracción, punto de ebullición, etc., y cambian cuando se modifica su composición. Para la mayoría de estas propiedades no se pueden dar reglas o leyes sobre la dirección o magnitud de sus cambios, puesto que los datos experimentales figuran en tablas separadas para cada conjunto de componentes (soluto y, disolvente). Sin embargo, los solutos, en disoluciones muy diluidas, y algunos grupos de substancias, aún en disoluciones de cualquier concentración (disoluciones ideales), tienen muchas de las propiedades de los gases.
ResponderBorrarLas propiedades coligativas son cuatro: disminución de la presión de vapor, depresión del punto de congelación, elevación del punto de ebullición y presión osmótica.
La Ley de Henry nos da la presión de vapor de un soluto en una disolución diluida ideal. Para el disolvente sigue aplicándose la Ley de Raoult. PA=xAP∗A
Con base en lo expuesto por la ley de Raoult, se menciona que la presión de vapor es conmensurable y proporcional a las fracciones de concentración de los solutos presentes, ya que ésta, relacionará la presión de vapor de un componente puro y la presión de la disolución. Y tiene sus aplicaciones en las destilaciones, puesto que tiene como objetivo separar los componentes puros; sin embargo, se diferencian por las temperaturas de ebullición a las que se estén sometidos los componentes.
ResponderBorrarPor otro lado, se encuentra la Ley de Henry, en la que se da la presión de vapor de un soluto en una disolución diluida ideal, tal es el caso de la disolución gaseosa en líquidos, ya que depende de la presión parcial y varía de acuerdo al gas y a la temperatura.
DIANA GUADALUPE JIMÉNEZ RIVAS IQ. 502
Este comentario ha sido eliminado por el autor.
ResponderBorrarSe muestra una información muy enriquecida y para complementar el contenido, según MARÓN Y PRUTTON (2001), se dice que pocos sistemas líquidos miscibles binarios obedecen la ley de Raould, en todo intervalo de concentraciones.
ResponderBorrarLa mayoría de los sistemas tienen tendencia a esta ley, ya sea en menor o mayor grado, esto depende de la naturaleza liquida, presión y temperatura; estas tendencias o desviaciones pueden juzgarse en figuras, donde se relacionan presiones totales y parciales con dependencia de una fracción molar.
Modesto Romero
ResponderBorrarEn el presente blog nos da a conocer las leyes de Roault y la de Henry en la ley de Raoult nos dice que si un soluto tiene una presión de vapor medible, la presión de vapor de su disolución siempre es menor que la del disolvente puro y dice que la ley de Henry "A temperatura constante y a saturación, la cantidad de gas disuelta en un líquido es proporcional a la presión ejercida por el gas en contacto con el líquido." Bueno aquí en ambas leyes específicas muchas las propiedades de las disoluciones, entre ellas densidad, índice de refracción y su punto de ebullición y cambian cuando se modifica su composición, en ejemplo de la botella se relacionan ambas leyes por que hablan de presión y temperatura.
De acuerdo al articulo anterior, se puede decir que la ley de Raoult es una ley aproximada que corresponde a la visión simplificada de una disolución; una de las características coligativas de las disoluciones es la disminución de la presión de vapor que ocurre cuando se agrega soluto a un disolvente puro; y fué Raoult quien encontró tal afirmación.
ResponderBorrarPor ende, en una solución ideal las presiones parciales de cada componente en el vapor, serán directamente proporcionales a sus respectivas fracciones molares en la disolución.
La ley Raoult
ResponderBorrarAl hablar de esta ley se nos menciona que, cuando se agregaba un soluto a un solvente puro disminuye la presión de vapor del solvente. Es decir, entre más se agrega más disminuye la presión de vapor. Viendo desde otro punto, la presión de vapor del solvente será menos como resultado de la presencia de las partículas del soluto. A mayor cantidad de partículas del soluto en la solución (aumento de la concentración) más posiciones superficiales serán bloqueadas. A esto, se le conoce como la ley de Raoult. Lo anterior tiene que ver también con las propiedades coligativas.
Por otro lado existe otra ley, llamada la ley de Henry que nos da la presión de vapor de un soluto en una disolución diluida ideal. Que nos menciona "A temperatura constante y a saturación, la cantidad de gas disuelta en un líquido es proporcional a la presión ejercida por el gas en contacto con el líquido."
El ejemplo de la botella gaseosa es un claro ejemplo para entender de lo que ocurre dentro de ella, antes y después que sea destapado.
Erik Noè Segundo
En el presente blog se habla sobre la ley de Raoult la cual establece que la presión de vapor del solvente en una solución es directamente proporcional a la fracción molar del solvente presente en la solución.
ResponderBorrarLas leyes que aquí se describen implican un factor k el cual depende de la temperatura debido a la variación de la presión de vapor, pero los valores relativos de k para dos componentes solo varían moderadamente con la temperatura, involucrando las presiones parciales del componente A en el vapor de Pa, Es claro cuando explica que la presión de vapor es directamente proporcional a la concentración del soluto presente, por lo tanto obedece a la ley de Raoult, recordando que la presión de vapor es la que libera un líquido inmediatamente después de ser retirado de cierta temperatura y sucede de manera natural. Es importante que la solución tengas sus propiedades coligativas para que así obedezcan claramente a la ley anteriormente mencionada con sus concentraciones bien definidas.
la información recopilada anteriormente nos otorga las herramientas necesarias para conocer la ley de Raoult, que va de la mano con la presión de vapor, analizada durante las clases de Fisicoquímica, y al mismo tiempo se relaciona de manera muy significativa en las aplicaciones de termodinámica, gradientes de temperatura, entre otros.
ResponderBorrarcabe mencionar que es de vital importancia conocer estos conceptos y relacionarlos a las distintas ramas de la química.
un ejemplo muy importante de la ley de DALTON es el siguiente:
Cuando se colocan en un recipiente varios gases que no reaccionan entre sí, las partículas de cada gas chocan contra las paredes del recipiente, independientemente de la presencia de los otros gases. Por esta razón es importante su análisis Químico para su fácil comprensión.
Como ya se mencionó anteriormente la ley de Raoult establece que la relación entre la presión de vapor de cada componente en una solución ideal es dependiente de la presión de vapor de cada componente individual y de la fracción molar de cada componente en la solución. Cabe mencionar que esta ley se puede afirmar siempre y cuando exista un equilibrio en los componentes.
ResponderBorrarAsí mismo La ley de Henry establece que la "masa de gas disuelto en un determinado volumen de solvente es directamente proporcional a la presión parcial del gas que está en equilibrio con la solución". Cabe mencionar que la presión de vapor que ocurre cuando se agrega un soluto a un disolvente puro.
bueno conforme a lo que leí en este blog nos explica claramente sobre la ley de Roault la cual explica que si un soluto tiene una presión de vapor medible, la presión de vapor de su disolución siempre sera menor que la del disolvente puro así como explica la relación entre la la presión de vapor de la solución y la presión de vapor del disolvente depende de la concentración del soluto ya que la ley de henry nos dice que a temperatura constante y a saturacion la cantidad de gas disuelta en un liquido es proporcional a la presión ejercida por el gas en contacto con el liquido y esta se aplica a cualquier soluto y como ultimo la la ley de roault se aplica solo a disoluciones ideales.
ResponderBorrarque para soluciones ideales establece que “la presión de Vapor de un componente de una mezcla es proporcional a la concentración de dicho componente y a la presión de vapor del componente puro”. Expresadas simbólicamente estas leyes adoptan la forma: Ley de Raoult: Pi = Pi*. Xi
ResponderBorrary la ley de henrey Esa ley dice que la solubilidad de un gas en agua depende de la presión parcial en esa ley varia con el gas y la temperatura, y revive el nombre de constante de Henry.
De acuerdo con la información anterior menciona tres leyes importantes:la primera es la Ley de Raoult que habla de la relación entre la presión de vapor de la solución y la presión de vapor del disolvente depende de la concentración del soluto en la disolución, es decir que la presión de vapor del soluto crece linealmente con su fracción molar.
ResponderBorrarLa siguiente Ley es la de Henry esta dice que la cantidad de gas disuelta en un líquido es proporcional a la presión ejercida por el gas en contacto con el líquido. Por ultimo tenemos a Dalton, el establece que la presión total que un gas ejerce una mezcla de gases es igual a la suma de las presiones parciales de los gases individuales.
Ademas se menciono también una pequeña introducción para la determinación de las partes por millón ya sea para fases liquidas y solidas.
El texto nos da a conocer algunas leyes como lo son la Ley de Raoult que habla de la relación entre la presión de vapor de la solución y la presión de vapor del disolvente depende de la concentración del soluto en la disolución, es decir que la presión de vapor del soluto crece linealmente con su fracción molar y esta se da solamente para soluciones ideales.
ResponderBorrarla ley de Henry nos habla de la cantidad de gas disuelta en un líquido es proporcional a la presión ejercida por el gas en contacto con el líquido.
La presión parcial de un gas ideal en una mezcla es igual a la presión que ejercería en caso de ocupar él solo el mismo volumen a la misma temperatura.
Este comentario ha sido eliminado por el autor.
ResponderBorrarLa ley de Raoult es muy importante ya que nos habla de la relación entre la presión de vapor de cada componente en una solución ideal ya que es dependiente de la presión de vapor de cada componente individual y de la fracción molar de cada componente en la solución. Y señala que:
ResponderBorrarSi un soluto tiene una presión de vapor medible, la presión de vapor de su disolución siempre es menor que la del disolvente puro su aplicación
Se cumple sólo para disoluciones ideales no obstante es una buena aproximación cualitativa ya que para que se cumpla al 100% la ley de Raoult es necesario que el líquido sea una disolución ideal, el vapor sea una mezcla de gases ideales y que la fugacidad del líquido no varie significativamente con la presión.
Tambien nos habla de la ley de Henry Esta ley se define con lo siguiente:A temperatura constante y a saturación, la cantidad de gas disuelta en un líquido es proporcional a la presión ejercida por el gas en contacto con el líquido, y la ley de Dalton que nos menciona que la presión total que un gas ejerce una mezcla de gases es igual a la suma de las presiones parciales de los gases individuales.
Tambien nos habla sobre presiones parciales, la presión parcial de un gas ideal en una mezcla es igual a la presión que ejercería en caso de ocupar él solo el mismo volumen a la misma temperatura. Esto sucede porque las moléculas de un gas ideal están tan alejadas unas de otras que no interactúan entre ellas. La mayoría de los gases reales se acerca bastante a este modelo.
La información plasmada en este blog comienza desde que es enunciada la ley de Raoult como tambien quien fue que la enuncio esta ley como bien se menciona esta ley nos dice que si un soluto tiene una presión de vapor medible, la presión de vapor de su disolución siempre es menor que la del disolvente puro y con esto se forma una relación entre la presión de vapor de la solución y la presión de vapor del disolvente estas dependen de la concentración del soluto en la disolución.
ResponderBorrarEs decir que la presión del soluto será proporcionalmente a la fracción molar que esté presente en la solución dependiendo de la concentración que se tenga.
La ley de Henry establece que la "masa de gas disuelto en un determinado volumen de solvente es directamente proporcional a la presiòn parcial del gas que esta en equilibrio con la soluciòn". En principio, la ley de Henry se aplica a cualquier soluto, asì que mientras que la ley de Raoult concibe el solvente ideal como aquel cuya presiòn de vapor es directamente proporcional a su fracciòn molar, de forma similar la ley de Henry ve el soluto ideal como aquel cuya presiòn de vapor es directamente proporcional a su fracciòn molar. Por tanto, en cierto sentido, la ley de Raoult puede considerarse como una aplicaciòn "especial" de la ley de Henry en la cual la constante de proporcionalidad tiene un valor particular (pº) igual a la presiòn de vapor del componente puro a la misma presiòn y temperatura.Tanto la ley de Raoult como la ley de Henry, nos dicen que la presión de vapor de un componente es proporcional a su fracción molar en la solución. . En la ley de Raoult, la constante de proporcionalidad es la presión de vapor del componente puro, P* , que depende de T y de la presión sobre el líquido. En la ley de Henry la constante de proporcionalidad es la constante de Henry, K, que depende de T, de la presión sobre el líquido y del solvente.
En este blog nos da a conocer la ley de Raoutl la cual nos dice que si un soluto tiene una presión de vapor, la presión de vapor de su disolución siempre es menor que la del disolvente y tenemos que la presión de vapor de la disolución es igual a la fracción molar del solvente por la presión de vapor del solvente en estado puro y esto nos permite demostrar que al momento de agregarle un soluto a un solvente la presión de vapor de la solución va disminuir y va depender directamente de la cantidad de soluto no volátil que se encuentra de la disolución, esta ley se cumple solo para disoluciones ideales. La ley de Henry nos dice que a temperatura constante y saturación, la cantidad de gas disuelta en un liquido es proporcional a la presión ejercida por el gas en contacto con el liquido, esto nos quiere decir que hay un estado de equilibrio. Por ultimo nos menciona presión parcial la cual se rige por la ley de las presiones parciales de Dalton, la cual establece que la presión total que un gas ejerce una mezcla de gases es igual a la suma de las presiones parciales de los gases individuales y se cumple en la mayoría de las mezclas gaseosas.
ResponderBorrarLa presente información nos da a conocer tres de las leyes mas importantes en la materia de fisicoquímica como primer punto tenemos que la Ley de Raoult: Establece que la relación entre la presión de vapor de cada componente en una solución ideal es dependiente de la presión de vapor de cada componente individual y de la fracción molar de cada componente en la solución.
ResponderBorrarEn principio, la ley de Henry se aplica a cualquier soluto, asì que mientras que la ley de Raoult concibe el solvente ideal como aquel cuya presiòn de vapor es directamente proporcional a su fracciòn molar, de forma similar la ley de Henry ve el soluto ideal como aquel cuya presiòn de vapor es directamente proporcional a su fracciòn molar.La ley de Henry dice que la cantidad de un gas disuelta en un líquido es proporcional a presión parcial de este en el líquido.
los componentes de una mezcla gaseosa parecieran ejercer presión sobre las paredes del recipiente en el cual estaban confinados de manera independiente unos de otros.
La ley de las presiones parciales de DALTON establece que la presión total que un gas ejerce una mezcla de gases es igual a la suma de las presiones parciales de los gases individuales.
La ley de las presiones parciales de Dalton se cumple en la mayoría de las mezclas gaseosas siempre y cuando los gases no reaccionen
Una de las características coligativas de soluciones es la disminución de la presión de vapor que ocurre cuando se agrega soluto a un solvente puro. Raoult encontró que cuando se agregaba soluto a un solvente puro disminuía la presión de vapor del solvente. Entre más se agrega más disminuye la presión de vapor. Por otra parte la ley de Henry relaciona la presión parcial del soluto en la fase de vapor con la fracción mol del soluto en la solución. La fraccion molar se emplea como limite para la propiedad a trabajar.
ResponderBorrarUna de las características coligativas de soluciones es la disminución de la presión de vapor que ocurre cuando se agrega soluto a un solvente puro. Raoult encontró que cuando se agregaba soluto a un solvente puro disminuía la presión de vapor del solvente. Entre más se agrega más disminuye la presión de vapor. Este estatuto llego a ser conocido como ley de Raoult.
ResponderBorrarDesde un punto de vista molecular, si introducimos partículas no-volatiles de soluto, iones o moléculas, en un solvente puro, algunas de las partículas del soluto tomarán la posición de moléculas solventes en la superficie de la solución. La evaporación es un fenómeno superficial por lo que las moléculas o iones no se convertirán en vapor cuando están sumergidas por debajo de la superficie. Las partículas sumergidas tienen a otras partículas que las rodean y las fuerzas entre éstas son suficientes para evitar que las partículas sumergidas superen dichas fuerzas con la energía cinética disponible para su separación. Sin embargo las partículas superficiales tienen solamente las partículas debajo de ellas en el estado líquido. Por lo tanto, las moléculas superficiales son capaces de superar estas fuerzas internas entre las partículas y entran en estado de vapor. Si las partículas del soluto toman el lugar de moléculas del solvente y son partículas de soluto no-volatiles, estas bloquean las moléculas de solvente y evitan la vaporización. Por lo tanto, la presión de vapor del solvente será menos como resultado de la presencia de las partículas del soluto. A mayor cantidad de partículas del soluto en la solución (aumento de la concentración) más posiciones superficiales serán bloqueadas.
Bueno el blog nos habla de que la ley de ROULT nos dice que la presión de vapor es directamente proporcional a la concentración del soluto presente y bueno algo de este blog y de lo que se ha visto es de que la presión de vapor es la que libera un liquido inmediatamente después de ser retirado de cierta temperatura y sucede de manera natural y va de la mano con propiedades coligativas para obtener soluciones para obtener fracciones molares para el vapor. También nos gabla de la ley de HENRY y nos dice que a una temperatura fija la cantidad de un gas disuelto en una cantidad dada de solvente es proporcional a la presión parcial del gas sobre la solución y conocer las propiedades parciales y saer cuales su temperatura, sustacias, temperatura y volumen
ResponderBorrarla ley de Henry se aplica a cualquier soluto, asì que mientras que la ley de Raoult concibe el solvente ideal como aquel cuya presiòn de vapor es directamente proporcional a su fracciòn molar, de forma similar la ley de Henry ve el soluto ideal como aquel cuya presiòn de vapor es directamente proporcional a su fracciòn molar. Por tanto, en cierto sentido, la ley de Raoult puede considerarse como una aplicaciòn "especial" de la ley de Henry en la cual la constante de proporcionalidad tiene un valor particular (pº) igual a la presiòn de vapor del componente puro a la misma presiòn y temperatura
ResponderBorrarey de Raoult.
Desde un punto de vista molecular, si introducimos partículas no-volatiles de soluto, iones o moléculas, en un solvente puro, algunas de las partículas del soluto tomarán la posición de moléculas solventes en la superficie de la solución. La evaporación es un fenómeno superficial por lo que las moléculas o iones no se convertirán en vapor cuando están sumergidas por debajo de la superficie.
jazmin garcia marquez
Ley de Raoult: Establece que la relación entre la presión de vapor de cada componente en una solución ideal es dependiente de la presión de vapor de cada componente individual y de la fracción molar de cada componente en la solución.
ResponderBorrarla ley de Henry se aplica a cualquier soluto, asì que mientras que la ley de Raoult concibe el solvente ideal como aquel cuya presiòn de vapor es directamente proporcional a su fracciòn molar, de forma similar la ley de Henry ve el soluto ideal como aquel cuya presiòn de vapor es directamente proporcional a su fracciòn molar.La ley de Henry dice que la cantidad de un gas disuelta en un líquido es proporcional a presión parcial de este en el líquido.
Esta ley establece que la relación entre la presión de vapor de cada componente en una solución ideal es dependiente de la presión de vapor de cada componente individual en la presión de vapor, es directamente proporcional a la concentración del soluto presente. Para que se cumpla al 100% la ley de Raoult es necesario que el líquido sea una disolución ideal, el vapor sea una mezcla degases ideales y que la fugacidad del líquido no varie significativamente con la presión, esta última condición a veces se expresa como que el factor de corrección de poynting sea de valor 1.Esto quiere decir que se puede hallar la constante de equilibrio para una reacción en equilibrio que involucre una mezcla de gases.
ResponderBorrarEste comentario ha sido eliminado por el autor.
ResponderBorrarEl químico Raoult al realizar demasiados estudios e innumerables experimentaciones establece en su ley que si un soluto tiene una presión de vapor medible, la presión de vapor de su disolución siempre es menor que la del disolvente puro, es decir la relación de las presiones de vapor de los componentes dependerá de la presión de vapor de cada componente, a pesar de que se utiliza para soluciones ideales es muy factible utilizarla para determinar propiedades cualitativas, a diferencia de la Ley de Henry la cual establece que a temperatura constante y a saturación, la cantidad de gas disuelta en un líquido es proporcional a la presión ejercida por el gas en contacto con el líquido y es aplicable a cualquier soluto.
ResponderBorrarLey de Raoult
ResponderBorrarEsta ley establece que la relación entre la presión de vapor de cada componente en una solución ideal es dependiente de la presión de vapor de cada componente individual y de la fracción molar de cada componente en la solución.
Aplicación
Se cumple sólo para disoluciones ideales no obstante es una buena aproximación cualitativa.
La ley de Henry
Esta ley se define con lo siguiente:
"A temperatura constante y a saturación, la cantidad de gas disuelta en un líquido es proporcional a la presión ejercida por el gas en contacto con el líquido."
Una forma de comprender bien esta Ley es "el ejemplo de la botella de gaseosa":
*La botella sin destapar tiene burbujas en su interior, parece agua pero sabemos que lleva CO 2 en su interior, sin embargo no se ve, esto es debido a que el gas por efecto de la presión a la que ha sido sometido durante el llenado se ha diluido en el líquido hasta alcanzar el estado de equilibrio. Al destapar la botella, la presión disminuye por efecto de la Ley de Henry y la cantidad de gas disuelto también disminuye, el gas sobrante es liberado en forma de burbujas.
La presión de vapor de un componente de una disolución, no es constante pero varía de acuerdo con la variación de la composición de la disolución. La curva que representa la variación de la presión vapor del componente con la composición de la disolución está dada por la Ley de Raoult.
ResponderBorrar〖P_i=x〗_i p_i
Esta ley es una ley límite, puesto que únicamente es una representación adecuada de la presión de vapor de un componente en disolución, si la fracción molar de este componente se acerca a la unidad. Cuanto más la solución se parezca al componente puro, más la presión del vapor del componente se acercara a la misma multiplicada por la presión, que es el valor dado por la ley de Raoult.
Cuando la disolución se convierte en una disolución infinitamente diluida, la presión de vapor se hace exactamente igual, puesto que se designa como solvente la componente que esta ene exceso en una disolución, por lo que la ley antes mencionada se asocia con la presión de vapor del solvente, y por ello se denomina como ley límite para el solvente. (Wentworth y colab., 1975).
ANAPRIMEROVICENTE
En el presente articulo nos abarca lo que es la presión de vapor en soluciones ideales utilizando diferentes leyes (ley de Raoult, ley de Henry y Dalton) definiendo de esta manera la relación entre la presión de vapor de la solución y la presión de vapor del disolvente que depende de la concentración del soluto en la disolución para que se encuentra en equilibrio y así poder cumplir con la ley de Raoult.
ResponderBorrarAsí mismo henry nos habla de algo relacionado de presión de vapor el cual dice que a temperatura constante y a saturación, la cantidad de gas disuelta en un líquido es proporcional a la presión ejercida el gas en contacto con el líquido.
Además con apoyo de Dalton el cual establece que las presiones totales en un gas ejercidas en una mezcla lo que es igual a la suma de presiones parciales de gases en el cual se encuentran individualmente pero que al final forman una una suma total para poder estar en equilibrio el cual demuestre la presión de vapor dentro del entorno.
Este comentario ha sido eliminado por el autor.
ResponderBorrarLa ley de Raoult y Henry establece la forma de como obtener la presión de vapor mediante concentraciones y fracciones parciales. Una solución para la presión de vapor también se puede obtener la presión de vapor en fases solidas o liquidas determinando las partes por millón y como bien describe de la ley de Raoult "Si un soluto tiene una presión de vapor medible, la presión de vapor de su disolución siempre es menor que la del disolvente puro." esto sucede porque el disolvente que se agrega depende mucho de su concentración.
ResponderBorrarY en la ley de Henry describe que "A temperatura constante y a saturación constante, la cantidad de gas disuelta en un líquido es proporcional a la presión ejercida por el gas en contacto con el líquido."
Para la presión parcial de un gas ideal en una mezcla es que esta es igual a la presión que ejercería en caso de ocupar él solo el mismo volumen a la misma temperatura. Esto sucede porque las moléculas de un gas ideal están tan alejadas unas de otras que no interactúan entre ellas; es por ello que la presión total, es decir la suma de todas estas presiones, de una mezcla en equilibrio es igual a la suma de las presiones parciales de los gases presentes.
Tanto la Ley de Raoult como La Ley de Henry son de gran importancia para el estudio de las formas de representar las concentraciones en sus distintas formas, y por ende estas dos leyes se globalizan y enfocan en un campo en especifico ambas son de vital importancia para la descripción molecular en disoluciones.
ResponderBorrarTanto la ley de Raoult como la ley de Henry, nos dicen que la presión de vapor de un componente es proporcional a su fracción molar en la solución. . En la ley de Raoult, la constante de proporcionalidad es la presión de vapor del componente puro, P* , que depende de T y de la presión sobre el líquido. En la ley de Henry la constante de proporcionalidad es la constante de Henry, K, que depende de T, de la presión sobre el líquido y del solvente.
La Ley de Henry: Enuncia que a una temperatura constante, la cantidad de gas disuelta en un líquido es directamente proporcional a la presión parcial que ejerce ese gas sobre el líquido. Matemáticamente se formula del siguiente modo:
C=k*p
donde:
p = la presión parcial del gas
c = la concentración del gas
k = la constante de Henry, que depende de la naturaleza del gas, la temperatura y el líquido
La Ley de Raoult: Establece que la relación entre la presión de vapor de cada componente en una solución ideal es dependiente de la presión de vapor de cada componente individual y de la fracción molar de cada componente en la solución. La ley debe su nombre al químico francés François Marie Raoult.
Ya lo mencionado anteriormente de la Ley de Radoult se puede concluir, que su enfoque es en cuestión de la presión de vapor, sin embargo dicha Ley establece que si un soluto tiene presión de vapor medible, la presión de su disolución será menor que la del disolvente puro que se esta manejando, de igual forma sera parcial y presente en cada componente de una mezcla ideal para los líquidos, sin embargo cabe mencionar que dichas presiones dependerán de la concentración del soluto en la disolución, es decir ira creciendo junto con la fracción molar.
ResponderBorrarPor otro lado la Ley de Henry se enfoca más a a temperatura constante y a la cantidad que es disuelta en el líquido, dado el caso si la presión del gas aumenta la concentración del gas disuelto también, en si, cuando el gas se encuentra diluido en el líquido habrá una presión hacia el gas que no se encuentra disuelto he aquí donde recibe el nombre de tensión, y a su vez desglosando 3 estados el de: a) Si P>T estado de subsaturación (el líquido absorbe más gas), b) Si P=T habrá un estado de equilibrio o saturación (ya no puede absorber más gas), c) Si P<T estado de sobresaturación (el liquido elimina gas).
Si bien es importante conocer que para cada Ley hay una reacción y como es el caso de las dos anteriores la presión utilizada lleva a diferentes resultados
La ley de Henry se aplica a cualquier soluto, así que mientras que la ley de Raoult espera que el solvente ideal como aquel cuya presión de vapor es directamente proporcional a su fracción molar, de igual forma para la ley de Henry. Por tanto, en cierto sentido, la ley de Raoult puede considerarse como una especial aplicación de la ley de Henry en la cual la constante de proporcionalidad tiene un valor particular igual a la presión de vapor del componente puro a la misma presión y temperatura.
ResponderBorrarla Ley de Raoult es de vital vital importancia la cual postula que para un solvente , su presión de vapor es igual a su fracción molar en solución multiplicada por la presión parcial del solvente puro, a temperatura constante, y gracias a esta ley podemos conocer otra de las tantas propiedades de los líquidos importantes para el desarrollo de la ciencia.
ResponderBorrarpor otra parte nos menciona la ley de Henry dice que a una temperatura constante la cantidad de gas disuelto en el liquido es directamente proporcional a la presión parcial que ejerce el gas sobre el liquido.
Esta ley nos dice cuanto gas puede llevar un liquido, en función de la presión que el gas ejerza sobre el liquido.
A mayor presión del gas sobre el liquido, mayor gas absorberá el liquido. y para esta ley se formulo para GASES.
Como se ha menciono en el artículo anterior la ley de Raoult establece que la presión de vapor es una solución que proporciona a la fracción molar del solvente se presente en la solución.
ResponderBorrarLa ley de Henry menciona que la "masa de gas disuelto en un determinado volumen de solvente y es directamente proporcional a la presión parcial del gas que está en equilibrio con la solución. Y la ley de las presiones parciales establecidas por Dalton dice que la presión total que un gas ejerce una mezcla de gases es igual a la suma de las presiones parciales de los gases individuales.
Menciona que la presión parcial de un gas es proporcional a su fracción molar, lo que es una medida de concentración. Esto quiere decir que se puede hallar la constante de equilibrio para una reacción en equilibrio que involucre una mezcla de gases.
Dentro del blog se abarcan las leyes de Henry y Raoult para las presiones de vapor. La informacion es la adecuada ya que complementa lo visto en la asignatura de Fisicoquimica I.
ResponderBorrarUn dato que podria aportar es que la ley de Henry es una forma de describir una solución ideal solo si es que cumple que no hay interacción entre moleculas de solvente y soluto.
Mientras que la de Raoult, encontró que cuando se agregaba soluto a un solvente puro disminuía la presión de vapor del solvente.
La información del presente blogs cabe resaltar que la presión de vapor o más comúnmente presión de saturación es la presión, para una temperatura dada, en la que la fase líquida y el vapor se encuentran en equilibrio dinámico; su valor es independiente de las cantidades de líquido y vapor presentes mientras existan ambas. Este fenómeno también lo presentan los sólidos; cuando un sólido pasa al estado gaseoso sin pasar por el estado liquido (proceso denominado sublimación o el proceso inverso llamado deposicitación o sublimación inversa) también se produce una presión de vapor. En la situación de equilibrio, las fases reciben la denominación de líquido saturado y vapor saturado. Esta propiedad posee una relación inversamente proporcional con las fuerzas de atracción intermoleculares, debido a que cuanto mayor sea el módulo de las mismas, mayor deberá ser la cantidad de energía entregada (ya sea en forma de calor u otra manifestación) para vencerlas y producir el cambio de estado.
ResponderBorrarEl presente Blog describe dos tipos de leyes las cuales son la Ley de Roult y Ley de Henry.
ResponderBorrarLa ley de Roult establece que la relación entre la presión de vapor de cada componente en una solución ideal es dependiente de la presión de vapor de cada componente individual y de la fracción molar de cada componente en la solución.
Es por ello que las soluciones se reales tienden a comportarse si estas mismas se aproximan a cero.
Otro punto es que a medida que el número de componentes gaseosos de la solución crece, la fracción molar y la presión en la solución de cada uno de ellos va decreciendo.
Ley de Henry
Esta ley enuncia que a temperatura y a saturación constante la cantidad de gas disuelta en un líquido es proporcional a la presión ejercida por el gas.
Para llevar a cabo la presión de vapor es necesario tener en cuenta 2 leyes muy importantes que es la Ley de Raoult y la Ley de Henry, que llevan una correlación entre ambas,por que nos dicen que la presión de vapor de un componente es proporcional a su fracción molar en la solución. . En la ley de Raoult, la constante de proporcionalidad es la presión de vapor del componente puro, P* , que depende de T y de la presión sobre el líquido. En la ley de Henry la constante de proporcionalidad es la constante de Henry, K, que depende de T, de la presión sobre el líquido y del solvente.
ResponderBorrarpara expplicar fenomenos comunes dentro de nuestra vida diaria, y dentro de la industria, existen don leyes dentro de la quimica que permiten explicar el fenomeno que existe en un liquido o gas, cuando este es sometido a una presion, y por su puestos los cambios que existen en ellos. Las dos leyes son conocidas como ley de Raoult y Henry. Para la ley de Raoult nos dice que "Si un soluto tiene una presión de vapor medible, la presión de vapor de su disolución siempre es menor que la del disolvente puro." y se cumple sólo para disoluciones ideales. En la ley de Henry, menciona que "A temperatura constante y a saturación, la cantidad de gas disuelta en un líquido es proporcional a la presión ejercida por el gas en contacto con el líquido." . Por lo tanto la presión influye muy poco en la solubilidad de un líquido o de un sólido.
ResponderBorrarLa presión de vapor es la presión de la fase gaseosa o vapor de un sólido o un líquido sobre la fase líquida, para una temperatura determinada, en la que la fase líquida y el vapor se encuentran en equilibrio dinámico; su valor es independiente de las cantidades de líquido y vapor presentes mientras existan ambas. Este fenómeno también lo presentan los sólidos; cuando un sólido pasa al estado gaseoso sin pasar por el estado líquido (proceso denominado sublimación o el proceso opuesto, llamado sublimación inversa) también hablamos de presión de vapor. En la situación de equilibrio, las fases reciben la denominación de líquido saturado y vapor saturado. Esta propiedad posee una relación inversamente proporcional con las fuerzas de atracción intermoleculares, debido a que cuanto mayor sea el módulo de las mismas, mayor deberá ser la cantidad de energía entregada (ya sea en forma de calor u otra manifestación) para vencerlas y producir el cambio de estado.
ResponderBorrarInicialmente sólo se produce la evaporación, ya que no hay vapor; sin embargo, a medida que la cantidad de vapor aumenta y por tanto la presión en el interior de la ampolla, se va incrementando también la velocidad de condensación, hasta que transcurrido un cierto tiempo ambas velocidades se igualan. Llegado este punto se habrá alcanzado la presión máxima posible en la ampolla (presión de vapor o de saturación), que no podrá superarse salvo que se incremente la temperatura.
La anterior información muestra a detalle la explicación sobre la ley de Raoult la cual nos dice que cuando se agrega soluto a un solvente puro disminuía la presión de vapor del solvente por lo tanto se ve un cambio en la presión de vapor al agregar un solvente puro para lo cual esta es una propiedad coligativa de soluciones que contienen soluciones no volátiles este documento explica ampliamente este tema que también va de la mano con la ley de Henry que nos dice que la cantidad de gas disuelta en un líquido a temperatura constante es proporcional a la presión parcial del gas sobre el líquido. En el ejemplo que nos presenta conforme a esta ley nos muestra un ejemplo claro de cómo se aplican y las condiciones que llega a tener. Otros temas importante son la determinación de fases sólidas y liquidas para lo cual se relaciona mucho con la ley de las gases ideales todo lo anterior me pareció un tema muy importante con lo que deja en explicado el tema.
ResponderBorrarEste comentario ha sido eliminado por el autor.
ResponderBorraren este blog se nos da a conocer dos leyes principalmente las cuales son la Ley de Raoult y Ley de Henry. La Ley de Henry nos dice que es aplicable sólo para disoluciones ideales sin embargo es una buena aproximación cualitativa, en esta ley interviene la temperatura la cual nos indica que a una temperatura constante, la cantidad de gas disuelta en un líquido es directamente proporcional a la presión parcial que ejerce ese gas sobre el líquido, mientras que la Ley de Raoult nos dice que la relación entre la presión de vapor de cada componente en una solución ideal es dependiente de la presión de vapor de cada componente individual y de la fracción molar de cada componente en la solución.
ResponderBorrarLa ley de Raoult establece que la presiòn de vapor del solvente en una soluciòn es directamente proporcional a la fracciòn molar del solvente presente en la soluciòn.
ResponderBorrarla ley de Henry establece que la "masa de gas disuelto en un determinado volumen de solvente es directamente proporcional a la presiòn parcial del gas que esta en equilibrio con la soluciòn". En principio, la ley de Henry se aplica a cualquier soluto, asì que mientras que la ley de Raoult concibe el solvente ideal como aquel cuya presiòn de vapor es directamente proporcional a su fracciòn molar, de forma similar la ley de Henry ve el soluto ideal como aquel cuya presiòn de vapor es directamente proporcional a su fracciòn molar. Por tanto, en cierto sentido, la ley de Raoult puede considerarse como una aplicaciòn "especial" de la ley de Henry en la cual la constante de proporcionalidad tiene un valor particular (pº) igual a la presiòn de vapor del componente puro a la misma presiòn y temperatura.
la información esta muy bien sintetizada, pero seria bueno que abarcara el comportamiento de estas leyes cuando ambas se presentan en una solución, por ejemplo el solvente se comporta de acuerdo a la ley de Raoult y el soluto a la ley de Henry
ResponderBorrarEste comentario ha sido eliminado por el autor.
ResponderBorrarEn este articulo nos deja en claro que para comprender la ley Raoult nos tenemos que adentrar a las especies por separado de una solucion, ya que cada uno de sus componentes es directamente proporcional a la presion de vapor total del mismo, ya que hay varios fenómenos que estan involucrados y otras leyes que se llevan de la mano como es la de Henry que nos hace mención de que los componentes que se someten a un estado de saturacion y presión constante respecto a un liquido y una gas, estas llegaran a un punto en el que la fuerza ejercida sera igual a la fuerza de separcion de las mismas pero no con la misma intensidad.
ResponderBorrarLa presión de vapor de todas las disoluciones de solutos no volátiles y no ionizados (que no sean electrólitos) es menor que la del disolvente puro. Lo cual queda expresado por la ley de Raoult: La disminución de la presión de vapor que se observa (cuando el soluto no es volátil ni fónico) en toda disolución con respecto a la del disolvente puro, es directamente proporcional al número de moléculas (fracción molar) del soluto por unidad del volumen del disolvente.
ResponderBorrarEste hecho se debe a que las moléculas del soluto dificultan la evaporación de las moléculas del disolvente que están en la superficie de la disolución al disminuir la presión de vapor tiene que elevarse al punto de ebullición de la disolución y disminuir su punto de congelación con respecto al del disolvente puro.
Mientras tanto la Ley de Henry nos dice “Para una temperatura constante, la concentración de un gas poco soluble en un líquido o el peso de un gas disuelto en un determinado volumen de líquido, es proporcional a la presión parcial del gas (Ley de Henry), siempre que esté muy diluida la disolución y el gas no reaccione con el disolvente”
La información presentada en este blog es clara pero se puede aumentar lo siguiente: Son muchas las propiedades de las disoluciones, entre ellas densidad, índice de refracción, punto de ebullición, etc., y cambian cuando se modifica su composición. Para la mayoría de estas propiedades no se pueden dar reglas o leyes sobre la dirección o magnitud de sus cambios, puesto que los datos experimentales figuran en tablas separadas para cada conjunto de componentes (soluto y, disolvente). Sin embargo, los solutos, en disoluciones muy diluidas, y algunos grupos de substancias, aún en disoluciones de cualquier concentración (disoluciones ideales), tienen muchas de las propiedades de los gases. Esto es explicable por las distancias proporcionalmente grandes que separan una molécula, del soluto, de otra, lo cual influye en las propiedades de las disoluciones que dependen sólo del número (concentración) de las moléculas o iones que constituyen el soluto. Las propiedades coligativas son cuatro: disminución de la presión de vapor, depresión del punto de congelación, elevación del punto de ebullición y presión osmótica.
Rebeca L.A
En la ley de Raoult, se dice que una de las características coligativas de soluciones es la disminución de la presión de vapor que ocurre cuando se agrega soluto a un solvente puro. Raoult encontró que cuando se agregaba soluto a un solvente puro disminuía la presión de vapor del solvente. Entre más se agrega más disminuye la presión de vapor.
ResponderBorrarOriginalmente, la Ley de Henry dice que a temperatura constante y a saturación, la cantidad de gas disuelta en un líquido es proporcional a la presión ejercida por el gas en contacto con el líquido. También esta ley es una forma de describir una solución ideal que se cumple si: No hay interacción entre moléculas de solvente y soluto diferentes a las que hay entre moléculas de soluto, la fugacidad del soluto varía linealmente con la solubilidad, expresada como fracción mol en la fase líquida y la presión parcial del soluto en fase vapor es tan baja que su solubilidad en el líquido es, también, muy baja.
La ley de las presiones parciales de Dalton establece que la presión de una mezcla de gases, que no reaccionan químicamente, es igual a la suma de las presiones parciales que ejercería cada uno de ellos si solo uno ocupase todo el volumen de la mezcla, sin cambiar la temperatura. La ley de Dalton es muy útil cuando deseamos determinar la relación que existe entre las relaciones parciales y la presión total de una mezcla de gases.
Dentro del siguiente artículo publicado nos da a conocer las leyes de raoult el cual hace mención y/o especifica la relación que tiene la presión de vapor que posee cada componente el cual involucra las fracciones molares que se tienen en el componente el cual no debe rebasar el 100% igual a 1 así como para la ley de henry da a conocer que cuando la presión parcial del gas aumenta, la concentración de gas disuelto también aumenta. Por lo tanto la información mostrada esta bien organizada y entendible.
ResponderBorrarLa información proporcionada en este blog da una idea sencilla y clara sobre lo que son dos leyes muy importantes, la diferencia entre una y la otra y algunas aplicaciones que tienen. La Ley de Raoult y la Ley de Henry. La primera es la ley que asegura que si un soluto tiene una presión de vapor medible, la presión de vapor de la disolución será menor que la del disolvente puro. Que la presión de vapor del soluto crece linealmente con su fracción molar. Es decir que la disminución o el aumento de la presión de vapor está ligada a la fracción molar del soluto. La segunda ley, la de Henry tiene que ver más con la temperatura y la saturación del soluto presente en la disolución. Esta dice que a una temperatura constante y a una saturación, la cantidad de gas disuelta en un líquido es proporcional a la presión parcial del gas sobre el líquido.
ResponderBorrarSe puede ver en la información anterior que la ley de Raoult nos da a conocer la relación existente entre la presión del vapor del disolvente dependiente de la concentración del soluto es decir la presión de vapor del soluto crece linealmente con su fracción molar y esta se da principalmente en soluciones ideales. Por otro lado la ley de Henry nos da a conocer la cantidad del gas que se encuentra disuelta en un líquido.
ResponderBorrarFabiola Colín Zepeda.
la ley de Raoult la ley la presion de vapor de cada componente en una solucion ideal que es dependiente de la presion de vapor de cada componente independiente y de la farccion molar de cada componente en la disolución. Asi tambien en un de henry nos dice que a una temperatura constante la cantidad disuelto en un liquido es directamente proporcional a la presión parcial que ejerce ese gas sobre el liquido
ResponderBorrarEste comentario ha sido eliminado por el autor.
ResponderBorrarEn el blog se nos da a conocer dos leyes las cuales son la Ley de Raoult y Ley de Henry en la ley de Raoult establece que la presiòn de vapor del solvente en una soluciòn es directamente proporcional a la fracciòn molar del solvente presente en la soluciòn mientras tanto la Ley de Henry nos dice que a temperatura constante y a saturación, la cantidad de gas disuelta en un líquido es proporcional a la presión ejercida por el gas en contacto con el líquido.
ResponderBorrarEste comentario ha sido eliminado por el autor.
ResponderBorrarSe podría decir que las leyes mencionadas en este articulo son de gran importancia ya que permiten conocer el comportamiento de los gases, así mismo como la relación entre las presiones dentro de un sistema.
ResponderBorrarEn la ley de Raoult se establece que la presión parcial de vapor de cada componente de una mezcla ideal de líquidos es igual a la presión de vapor del componente puro multiplicado por la fracción molar del componente dentro de la mezcla y solo se cumple para disoluciones ideales .
En la La LEY de HENRY se dice que a una temperatura constante la cantidad de gas disuelto en el liquido es directamente proporcional a la presion parcial que ejerce el gas sobre el liquido.
Esta ley nos dice "cuanto" gas puede llevar un liquido, en función de la presión que el gas ejerza sobre el liquido.
A mayor presión del gas sobre el liquido, mayor gas absorberá el liquido.
De acuerdo al artículo anterior Ley de Raoult Expresa que la presión de vapor parcial del constituyente volátil de una solución es igual a la presión de vapor del constituyente puro multiplicada por la fracción molar del constituyente en la solución.
ResponderBorrarEn cuanto a la ley de Henry se dice que la solubilidad de un gas en agua depende de la presión parcial en esa ley varia con el gas y la temperatura, y revive el nombre de constante de Henry.
El blog nos habla sobre la ley de Raoult y Henry dice que la ley de Raoult establece la relación entre la presión de vapor de cada componente en una solución ideal es dependiente de la presión de vapor de cada componente individual y de la fracción molar de cada componente en la solución. A su vez la ley de Henry tiene que ver más con la temperatura y la saturación del soluto presente en la disolución. Dice que a una temperatura constante y a una saturación, la cantidad de gas disuelta en un líquido es proporcional a la presión parcial del gas sobre el líquido.
ResponderBorrarEl comportamiento de las presiones, en diferentes contextos representan un cambio en sus variables así como sus propiedades fisicoquimicas. Me parece interesante la ley Raoult que nos dice que un soluto tiene una presión de vapor medible, la presión de vapor de su disolución siempre es menor que la del disolvente puro, que lo vemos claramente con el ejemplo del NaCl y el agua, siendo NaCl el soluto y el agua el disolvente, el cual en consideracion a las presiones que pueden ser ejercidas en un proceso, la presion de vapor del agua disminuira.
ResponderBorrarEn el caso de la ley de Henry, es importante considerar si un soluto tiene una presión de vapor medible, la presión de vapor de su disolución siempre es menor que la del disolvente puro, es decir que tiende a un cambio de solubilidad.
Estas dos leyes son un claro ejemplo del comportamiento que ejerce la presión de vapor en los estados físicos.