* Ley de Raoult
La ley fue enunciada en 1882 por el químico francés Francois Marie Raoult (1830-1901).
Esta ley establece que la relación entre la presión de vapor de cada componente en una solución ideal es dependiente de la presión de vapor de cada componente individual y de la fracción molar de cada componente en la solución.
Y señala que:
"Si un soluto tiene una presión de vapor medible, la presión de vapor de su disolución siempre es menor que la del disolvente puro."
Definiéndolo de esa manera la relación entre la presión de vapor de la solución y la presión de vapor del disolvente depende de la concentración del soluto en la disolución.
Entonces tendríamos:
Es decir que la presión de vapor del soluto crece linealmente con su fracción molar. En una solución que sólo contenga un soluto, se tiene que X1= 1 – X2, donde X2 es la fracción molar del soluto, pudiendo escribir la formulación de la ley como:
Se puede ver de esta forma que una disminución en la presión de vapor, 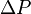 es directamente proporcional a la concentración del soluto presente.
es directamente proporcional a la concentración del soluto presente.
Sí la solución tiene presiones de vapor parciales que sigan esta ecuación, se dice que dicha solución sigue la ley de Raoult y se comporta de manera ideal. Las soluciones reales se ajustan a la ley de Raoult cuanto más diluida es la solución. Es decir todas las soluciones reales se comportan idealmente cuando la concentración de los solutos se aproxima a cero.
Una vez que los componentes de la solución han alcanzado el
equilibrio químico, la presión total del vapor es:
y la presión individual de los componentes gaseosos es
donde
- (Pi)puro es la presión de vapor del componente puro
- Xi es la fracción molar del componente en solución
Consecuentemente, a medida que el número de componentes gaseosos de la solución crece, la fracción molar y la presión en la solución de cada uno de ellos va decreciendo. Si se tuviera un soluto puro, tendiendo a infinito número de solutos, se alcanzaría el valor nulo de presión de vapor (es decir el cuerpo no se evaporaría). En este caso la presión de vapor de la disolución sería igual a la suma de las presiones parciales de cada componente (Ley de las presiones parciales o ley de Dalton).
Aplicación
Se cumple sólo para disoluciones ideales no obstante es una buena aproximación cualitativa.
Disoluciones ideales
Para que se cumpla al 100% la ley de Raoult es necesario que el líquido sea una disolución ideal, el vapor sea una mezcla de gases ideales y que la fugacidad del líquido no varie significativamente con la presión, esta última condición a veces se expresa como que el factor de corrección de poynting sea de valor 1.
En equilibrio líquido-vapor, la relación que se comporta según la idealidad de la ley de Raoult seria la siguiente:
donde:
 = presión total del sistema en equilibrio
= presión total del sistema en equilibrio = composición en la fase vapor, compuesto 1
= composición en la fase vapor, compuesto 1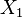 = composición en la fase líquida, compuesto 1
= composición en la fase líquida, compuesto 1 = presión de vapor, compuesto 1
= presión de vapor, compuesto 1
* La ley de Henry
Esta ley se define con lo siguiente:
"A temperatura constante y a saturación, la cantidad de gas disuelta en un líquido es proporcional a la presión ejercida por el gas en contacto con el líquido."
Una forma de comprender bien esta Ley es "el ejemplo de la botella de gaseosa":
*La botella sin destapar tiene burbujas en su interior, parece agua pero sabemos que lleva CO 2 en su interior, sin embargo no se ve, esto es debido a que el gas por efecto de la presión a la que ha sido sometido durante el llenado se ha diluido en el líquido hasta alcanzar el estado de equilibrio. Al destapar la botella, la presión disminuye por efecto de la Ley de Henry y la cantidad de gas disuelto también disminuye, el gas sobrante es liberado en forma de burbujas.
De manera matemática,  (La cual es una forma de plantear la ley de Henry, pero no la más útil).
(La cual es una forma de plantear la ley de Henry, pero no la más útil).
Cuando una persona entra en la CHIPER, su organismo se encuentra en un estado de saturación en el ambiente atmosférico, que es el habitual. Una vez iniciada la presurización, se crea un desequilibrio, lo cual obliga al líquido y a los tejidos a aumentar la tasa de gas en busca de un nuevo estado de equilibrio (saturación).
Una vez el gas está disuelto en el líquido, experimentará una presión (P) hacia el gas sin disolver, que se conoce con el nombre de tensión (T), dependiendo de los valores de la presión y de la tensión habrá lugar a tres estados de disolución:
*Si P > T Estado de Subsaturación
En el estado de subsaturación, el líquido absorbe más gas, debido a que la presión del gas es mayor que la tensión del gas en el líquido, que en el paciente es el momento del comienzo de la presurización.
*Si P = T Estado de equilibrio o Saturación
En el estado de saturación, el líquido ya no puede absorber más gas a esa presión, debido a que la presión del gas es igual a la tensión de dicho gas en el seno del líquido; es la base del buceo a saturación.
*Si P < T Estado de Sobresaturación
En el estado de sobresaturación, el líquido elimina gas porque la presión del gas es menor que la tensión del gas en el seno del líquido, que en el buceador y en el paciente se da en el momento del ascenso.
*DETERMINACIÓN DE PPM EN FASES LÍQUIDAS*
ppm significa partes por millón, es decir, los mg (miligramos) que hay en un kg de disolución; como la densidad del agua es 1, 1 kg de solución tiene un volumen de aproximadamente 1 litro, los ppm son también los mg de una sustancia en un litro
Expresado de otra forma: mg/l
(Siguiendo el mismo razonamiento, los ppm también son los gramos que contiene cada metro cúbico, g/m3)
Para calcular los ppm se divide el peso en mg por el volumen el litros.
Por ejemplo, una disolución de 15 gramos (g) en 3 metros cúbicos de agua:
15 g x 1000 mg/g = 15000 mg
3 m3 x 1000 l/m3 = 3000 l
Concentración: 15000 / 3000 = 5 mg/l = 5 ppm
*DETERMINACIÓN DE PPM EN FASES SÓLIDA*
Partes por millón (abreviado como ppm) es la unidad empleada usualmente para valorar la presencia de
elementos en pequeñas cantidades (traza) en una mezcla. Generalmente suele referirse a porcentajes
en peso en el caso de sólidos y en volumen en el caso de gases (caso del ppm utilizado en calidad
del aire).
Así, 5 ppm de CO equivale a decir que existen 5 unidades de volumen de CO por cada millón de
unidades de volumen de aire. Por ejemplo, 5 ppm de CO serían 5 litros de CO en cada millón de litros
de aire.
De forma análoga, para transformar N ppm de un gas a mg/m3
en determinadas condiciones de Presión
y Temperatura, se realiza con:
Nppm x M/V(atm.T) = mg/m3
* Presiones Parciales
En 1801 John Dalton postulo “ los componentes de una mezcla gaseosa parecieran ejercer presión sobre las paredes del recipiente en el cual estaban confinados de manera independiente unos de otros”.
La ley de las presiones parciales de DALTON establece que la presión total que un gas ejerce una mezcla de gases es igual a la suma de las presiones parciales de los gases individuales.
La ley de las presiones parciales de Dalton se cumple en la mayoría de las mezclas gaseosas siempre y cuando los gases no reaccionen
PT = P1 + P3 + P3 + ……… + P n
La presión parcial de un gas ideal en una mezcla es igual a la presión que ejercería en caso de ocupar él solo el mismo volumen a la misma temperatura. Esto sucede porque las moléculas de un gas ideal están tan alejadas unas de otras que no interactúan entre ellas. La mayoría de los gases reales se acerca bastante a este modelo.
Como consecuencia de esto, la presión total, es decir la suma de todas estas presiones, de una mezcla en equilibrio es igual a la suma de las presiones parciales de los gases presentes. Por ejemplo, para la reacción dada:
- N2 + 3H2 ↔ 2NH3
La presión total es igual a la suma de las presiones parciales individuales de los gases que forman la mezcla:

Donde P es la presión total de la mezcla y Px denota la presión parcial de x.
Para calcular la presión parcial de un gas basta con multiplicar su fracción molar por la presión total de la mezcla. Es decir:

Si se disminuye el volumen del recipiente, la presión total de los gases aumenta. Por ser la reacción reversible, la posición de equilibrio se mueve hacia el lado de la reacción con un menor número de moles (en este caso, el producto del lado derecho). Por el Principio de Le Châtelier, esto sería como aumentar la fracción de la presión completa disponible a los productos, y disminuir la fracción disponible a los reactivos (porque hay más moles de reactivo que de producto). Varía la composición de los gases, por lo que aumenta la presencia de amoníaco. De forma similar, un cambio en la temperatura del sistema propicia la producción de reactivos (porque la reacción inversa es endotérmica).
La presión parcial de un gas es proporcional a su fracción molar, lo que es una medida de concentración. Esto quiere decir que se puede hallar la constante de equilibrio para una reacción en equilibrio que involucre una mezcla de gases a partir de la presión parcial de cada uno y la fórmula química de la reacción. La constante de equilibrio para los gases se denota como KP. Para una reacción:
- aA + bB ↔ cC + dD
Así, la constante de equilibrio KP se puede calcular con,

Aunque la composición de los gases varía cuando se comprime el recipiente, el equilibrio permanece invariante (asumiendo que la temperatura permanezca también constante).
Fase líquida frente a fase gaseosa
La presión parcial en un fluido es igual a la del gas con el que el fluido está en equilibrio.
Cuando se expone un líquido a un gas, las moléculas del gas se disolverán en el líquido.












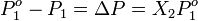
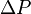



 = presión total del sistema en equilibrio
= presión total del sistema en equilibrio = composición en la fase vapor, compuesto 1
= composición en la fase vapor, compuesto 1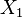 = composición en la fase líquida, compuesto 1
= composición en la fase líquida, compuesto 1 = presión de vapor, compuesto 1
= presión de vapor, compuesto 1















